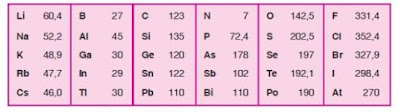
Ilmukimia - PengertianZat Radioaktif sendiri menurut UU No. 10/1997 tentang ketenaganukliran, adalah setiap zat yang memancarkan radiasi pengion dengan aktifitas jenis lebih besar dari 70kBq/Kg. Sedangkan Limbah Radioaktif adalah zat radioaktif dan bahan serta peralatan yang terkontaminasi zat radioaktif atau menjadi radioaktif, karena pengoperasian instalasi nuklir yang tidak dapat digunakan lagi. Contoh bahan radioaktif adalah Uranium, thorium, neptunium, actinium dan rubidium.
Klasifikasi limbah radioaktif berdasarkan bentuk fisisnya:
a. Gas.
Limbah radioaktif ada yang berwujud gas seperti udara yang berasal dari tambang Uranium, udara dari pembakaran limbah radioaktif padat, gas dari penguapan cairan radioaktif, udara dari ventilasi pabrik pengolahan Uranium, cerobong reaktor dan sejenisnya. Khusus untuk limbah radioaktif bentuk gas, klasifikasinya berdasarkan jumlah aktivitas, bukan berdasarkan pada konsentrasinya.
b. Padat
Limbah radioaktif yang berwujud padat dapat berupa jarum suntik bekas, alat gelas untuk zat radioaktif, binatang percobaan, resin alat bekas pabrik pengolahan Uranium dan lain sejenisnya. Penanganan limbah radioaktif padat lebih rumit dibanding penanganan limbah radioaktif cair, kesulitan tersebut terletak pada cara penanganannya dan pengangkutannya.
 |
| Gambar 1. Limbah Padat Radioaktif |
c. Cair
Contoh limbah radioaktif cair adalah seperti cucian benda yang telah terkontaminasi zat radioaktif, limbah hasil penelitian, limbah laboratorium dan pabrik pengolahan Uranium.
 |
| Gambar 2. Limbah Cair Radioaktif |
Meski manfaatnya sangat luas, tak dipungkiri, tenaga nuklir juga memiliki potensi bahaya yang tidak kecil bagi kesehatan maupun keselamatan manusia. Penyakit-penyakit yang timbul akibat radiasi, misalnya kanker, leukimia, rusaknya jaringan otak, serta kerugian fisik lainnya.
International Atomic Energy Agency (IAEA) dan World Health Organization (WHO), memberikan informasi menarik tentang luka yang akan timbul akibat terkena radiasi. Disebutkan, luka radiasi tidak memiliki tanda dan gejala yang khusus sehingga sangatlah penting bagi masyarakat atau dokter terutama dokter umum untuk mengetahui efek dari kecelakaan radiasi.
Dijelaskan IAEA dan WHO, bahwa pancaran radiasi dapat berupa eksternal ke tubuh, yakni pancarannya ke seluruh tubuh atau terbatas untuk bagian besar atau bagian kecil di anggota tubuh. Bisa juga berupa internal karena kontaminasi dengan material radioaktif, jika termakan, terminum, terhirup, atau menempel di dalam luka. Pancaran itu sendiri dapat bersifat akut, berlarut-larut atau kecil, tergantung pada dosis radiasinya.
Jenis pancaran radiasi yang mungkin timbul dari sebuah kecelakaan, ada tiga macam.
a. Pertama, Pancaran Seluruh Tubuh akibat penetrasi sumber radiasi yang termasuk fase prodromal awal dengan gejala, seperti mual, pusing, kemungkinan demam, dan mencret serta diikuti oleh sebuah periode laten dengan panjang beragam. Kemudian diikuti dengan periode kesakitan (illness) yang dikarakteristikkan oleh infeksi, pendarahan, dan gejala gastrointestinal.
b. Kedua, Pancaran Lokal. Pancaran ini tergantung seberapa besar dosis yang diterima dan biasanya memberikan tanda dan gejala pada area yang terkena pancaran berupa erythema, oedema, desquamation kering dan basah, blistering, pain, pembusukan, gangrene, atau kerontokan rambut. Luka-luka kulit lokal bertambah secara perlahan seiring waktu, lazimnya minggu atau bulan, dan jika dibiarkan akan menjadi sangat sakit. Metode pengobatannya pun bukan metode yang biasa.
c. Ketiga, Pancaran Tubuh Sebagian. Efeknya yang ditimbulkan tergantung pada dosis dan volume bagian tubuh yang mengalami pancaran radiasi. Biasanya tak ada gejala awal jika mengalami kontaminasi internal kecuali dosisnya sangat tinggi atau berlebihan. Untuk pancaran radiasi ini sangat jarang terjadi.
 |
| Gambar 3. Dampak Zat Radioaktif bagi Tubuh |
Cara penanganan zat ridioaktif berbeda beda tergantung dari sifat dan jumlah bahan yang terbuang. Bila perusahaan menyimapan bahan kimia dalam jumlah besar yang dikirim dengan tempat yang besar (truk tanker atau kereta), maka harus disiapkan tindakan untuk merespon insiden atas bahan dalam jumlah besar. Bahan yang terbuang dalam jumlah besar mungkin memerlukan evakuasi perusahaan, tempat tumpahan, dan pembersihan dan pembuangan bahan sisa limbah. Jumlah bahan yang terbuang dalam jumlah kecil mungkin hanya memerlukan sedikit persiapan lanjutan.
Secara umum, prosedur tanggap darurat harus ditargetkan untuk bahan kimia yang disimpan dalam tangki besar atau digunakan secara luas di perusahaan, dengan persyaratan terdapat semua pelaporan peraturan yang spesifik pada saat terbuangnya bahan kimia, dan pada bahan berbahaya yang akut, walaupun dalam jumlah kecil. Apakah insiden mengandung tumpahan bahan berbahaya atau terbuangnya gas atau uap, koordinasi masyarakat merupakan hal yang kritis bila terbuangnya bahan kimia mungkin memiliki dampak keluar perusahaan. Karenanya, perusahaan yang mungkin mengalami terbuangnya bahan kimia dengan potensi berdampak keluar perusahaan harus memiliki suatu mekanisme dalam memberikan peringatan dini yang memberitahukan bangunan tetangga dan masyarakat. Menggunakan sensor dan detektor kebocoran bahan kimia yang tepat dapat membantu memberikan peringatan dini saat terjadi terbuangnya bahan kimia.
Pelepasan atau kecelakaan dalam waktu cepat yang melibatkan bahan kimia berbahaya dapat menjadi ancaman bagi karyawan perusahaan,masyarakat, dan lingkungannya. Persiapan-persiapan ini harus menjamin bahwa prosedur yang efektif dilakukan untuk mengendalikan setiap potensi keadaan darurat akibat bahan kimia ini. Rencana ini memberikan alat bantu yang penting untuk mengevaluasi bahaya bahan kimia di perusahaan dan menjamin cara-cara yang tepat ditempat untuk mengontrol bahan kimia tersebut pada situasi darurat.
Rencana ini juga dimaksudkan untuk membantu perusahaan untuk mengembangkan prosedur tanggapan darurat atas bahan kimia. Saat mengembangkan prosedur-prosedur ini, perusahaan harus memperhatikan peraturan setempat yang mungkin mengharapkan kegiatan respon khusus dan pemberitahuan pada lembaga setempat yang berwenang. Prosedur yang mungkin perlu dikembangkan oleh perusahaan mungkin berbeda tergantung dari bahan kimia yang digunakan.
Pengendalian bahaya-bahaya bahan kimia menyangkut manajemen resiko dan prosedur tanggap darurat. Kegiatan manajemen resiko memainkan peran penting dalam pencegahan kecelakaan terlepasnya dan keadaan darurat bahan kimia.
Disamping itu untuk limbah radioaktif dapat pula di daur ulang ( Nuklir ), seperti terlihat pada gambar 4
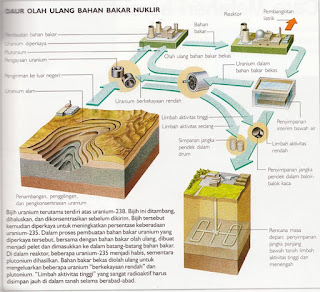 |
| Gambar 4. Skema Daur ulang Limbah radioaktif |