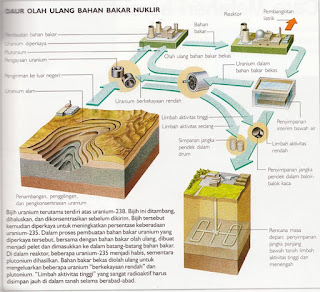
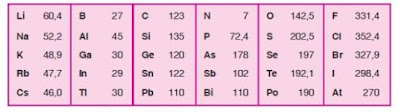
Teorikimia - Pompa adalah suatu alat yang berfungsi untuk memindahkan fluida cair dari suatu tempat ke tempat lain, dari suatu tempat yang rendah ke tempat yang lebih tinggi atau dari suatu tempat bertekanan rendah ketempat tekanan yang lebih tinggi,melalui media perpipaan (saluran) dengan cara menambah enersi pada cairan yang di pindahkan dan berlangsung secara kontinyu.
Pompa beroperasi dengan mengadakan perbedaan takanan antara bagian masuk (suction) dan bagian keluar (Discharge). Dengan kata lain pompa berfungsi mengubah tenaga mekanis dari suatu sumber tenaga (penggerak) menjadi tenaga cairan,dimana tenaga ini berguna untuk mengalirkan cairan dan mengatasi hambatan yang ada sepanjang Pengaliran.
 |
| Gambar Screw Pump |
Sedangkan compresor adalah suatu alat yang fungsinya untuk menaikan tekanan dari fluida yang kompresibel (dapat dimampatkan) seperti udara dan gas.kenaikan tekanan udara atau gas yang dihasilkan compressor. Disebabkan adanya proses pamampatan yang dapat berlangsung secara berselang dan kontinyu, compresor dapat beroperasi dengan tekanan masukdibawah atmosfer (Vacum) sampai dengan tekanan tinggi (positip) diatas atmosfer,sedangkan tekanan keluar memiliki tingkatan dari tekanan atmosfer sampai dengan tekanan tinggi diatas sepuluh ribu pound per inch kwadrat.
Compressor secara umum digunakan untuk keperluan proses ,transfortasi dan distribusi udara/gas pada pabrik petrokimia,produksi dan pengolahan migas dan lain-lain.Pompa dan compressor punya prinsip dasar yang sama.
KLASIFIKASI POMPA
Pompa dapat digolongkan menjadi 2 (dua) yaitu :
1. Positive Displacement Pump.
Positive Displacement Pump adalah pompa yang aliran zat cairnya yang disebabkan desakan oleh bagian pompa.
2. Dynamic Pump.
Dynamic Pump adalah pompa yang aliran zat cairnya yang disebabkan adanya suatu gaya sentrifugal dari perputaran bagian pompa.
Positive Dsplacement pump dapat dibedakan menjadi 2 (dua) yaitu :
1. Reciprocating Pump :
a). Piston Pump.
b). Plunger Pump.
2. Rotating Pump :
1). Gear Pump (pompa roda gigi)
2). Screw Pump ( Pompa Sekrup)
3). Sliding Vane Pump dll
 |
Gambar Positive Dsplacement pump |
Klasifikasi Pompa positive Displacement adalah :
a. Dari segi siklus operasi :
1). Single acting.
2). Double acting
b. Dari jumlah liquid cylinder :
1). Single cylinder
2). Multi Cylinder
c. Dari segi jumlah power cylinder :
1). Simplex
2). Duplex
d. Dari segi posisi cylinder :
1). Vertical
2). Horizontal
e. Dari segi elemen pompa :
1). Piston
2). Plunger
f. Dari segi tekanan :
1). Low pressure
2). Meium pressure
3). Hight pressure
4). Extra hight
g. Dari segi jenis daya :
1). Steam
2). Internal combation engine (motor bakar)
3). Electric
4). Hydroulic
Dynamic Pump.
Dynamic Pump dapat dibedakan 3 (tiga) yaitu :
1. Centrifugal Pump
2. Mixed Flow Pump
3. Axial Flow Pump.
Klasifikasi Pompa Centrifugal adalah
a. Menurut bentuk casing :
1). Volute pump
2). Diffuser pump.
 |
| Instalasi pompa centrifugal pada sebuah site |
b. Menurut bentuk Impeller :
1). Open empeller
2). Semi open empeller
3). Encloced impeller
c. Menurut intake :
1). Single suction
2). Double suction
d. Menurut tingkat operasi (stage)
1). Single stage
2) Double stage
e. Menurut out put :
1). Large volume – low head
2). Medium volume – medium head
3). Small volume – hight head
f. Menurut letak poros :
1). Horizontal
2). Vertical
PENGGUNAAN POMPA
Pada industri migas dan petrokimia penggunaan pompa sangat luas antara lainsebagai:
- Pompa proses.
- Pompa distribusi prodak.
- Pompa booster (pompa penguat).
- Pompa hydroulic.
- Pompa pelumas.
- Pompa lumpur (bidang pemboran).
- Pompa pendingin.
- Pompa fire fighting (pemadam kebakaran).
Dipasaran terdapat bermacam-macam jenispompa yang diproduksi dari berbagai manufacture. Untuk dapat memilih pompa yang tepat,diperlukan data spesifikasi yang sesuai dengan kebutuhan operasi ,kemudian dari berdasarkan hal tersebut bisa dilihat dari catalog yang dikeluarkan dari manufactur, sehingga diperoleh pompa yang efisien dan ekonomis.
PEMILIHAN POMPA
Pemilihan Pompa dapat dilaksanakan berdasarkan beberapa parameter operasi, yaitu :
1. Kapasitas
2. Tekanan
3. Kombinasi tekanan dan kapasitas
4. Tinggi angkat statis
5. Jenis Liquid yang dihandle
Salah satu panduan dalam memilih jenis pompa adalah dengan cara melihat data spesifikasi dari catalog yang dikeluarkan oleh manufacture.